肺炎链球菌(Streptococcus pneumoniae,S.pn)是导致全球肺炎高死亡率的主要病原体,每年造成超100万例死亡,其强致病性与其复杂的毒力机制密切相关。蛋白质翻译后修饰(PTMs)在调控生物学过程中发挥关键作用,但在细菌毒力中的具体机制尚不明确。近日,暨南大学生科院生化系孙雪松/何庆瑜团队在国际学术期刊《Journal of Advanced Research》(中科院1区,IF 13.0)发表重要研究成果。该团队首次在S.pn中发现并鉴定了巴豆酰转移酶SPD_0839,系统揭示了其通过介导巴豆酰化修饰(Crotonylation,Kcr)调控细菌致病性的分子机制。该成果不仅深化了我们对S.pn宿主适应性存活与毒力调控的认知,更为研发靶向巴豆酰化通路的新型抗菌药物提供了理论依据。

动物模型显示临床多重耐药S.pn菌株对小鼠表现出增强的侵袭性但减弱的毒力,这一矛盾现象后的机制有待深究。该研究团队采用定量差异蛋白质组学结合动物模型发现Kcr是调控细菌毒力与宿主适应性的关键,通过对Kcr修饰蛋白质组学筛选鉴定出S.pn中巴豆酰基转移酶SPD_0839,其通过催化Kcr调控细菌生长与代谢等重要生命进程。进一步利用抗体富集结合蛋白质组学技术绘制了酶-底物网络,发现过表达SPD_0839上调了153个底物蛋白上的205个Kcr位点,增强了一系列参与能量代谢的关键酶的Kcr水平,从而负控细菌能量代谢。
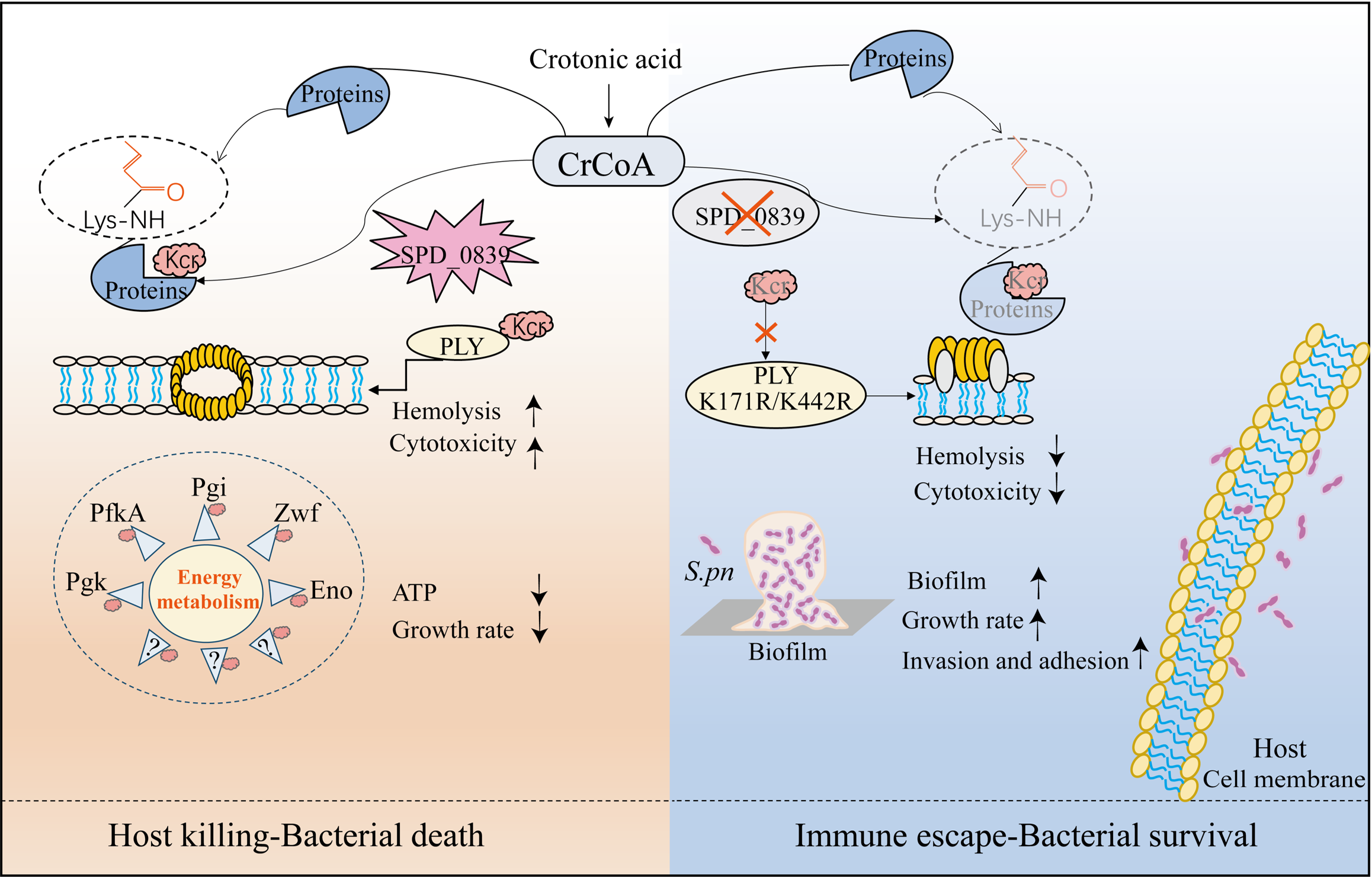
更关键的是,SPD_0839通过催化关键毒力因子溶血素(Pneumolysin,PLY)Lys171和Lys442处的Kcr,增加了其聚合及成孔能力,进而增强细菌对宿主细胞的溶血活性和毒力,这一发现揭示了细菌在宿主内通过PTMs的精细调控策略进行适应性生存的分子机制。
暨南大学孙雪松研究员与何庆瑜教授为论文的共同通讯作者,高级实验师李楠博士是文章的第一作者,该研究得到国家自然科学基金和广东省自然科学基金的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2090123225004540

