肝细胞癌(HCC)作为全球癌症死亡的主要原因之一,其侵袭转移能力是导致患者预后不佳的关键因素。近期,我院张志毅教授课题组与中科大科研团队合作深入研究探讨了剪接变体UPF3B-S在HCC侵袭转移中的作用及其分子机制,为HCC的诊疗提供了新的生物标志物和潜在治疗靶点。
研究团队采用BaseScope方法精确检测了UPF3B-S mRNA在肝癌组织中的表达水平,并结合分子细胞生物学实验,通过细胞和动物模型,全面分析了UPF3B-S在HCC中的表达模式、临床意义及其调控机制。研究发现,剪接因子HnRNPR通过其RRM2结构域与UPF3B pre-mRNA特异性结合,促使8号外显子的跳跃,产生UPF3B-S剪接变体。UPF3B-S在HCC组织中的高表达与肿瘤的侵袭性和患者的不良预后显著相关。
进一步的实验结果揭示,沉默UPF3B-S能显著抑制HCC细胞的侵袭和迁移能力。UPF3B-S通过与CDH1 mRNA的3'-UTR结合,促进了CDH1 mRNA的降解,导致E-cadherin蛋白的下调,进而触发上皮-间质转化(EMT)。此外,UPF3B-S的过表达还抑制了LATS1的磷酸化,增加了YAP1蛋白在细胞核中的积累,从而抑制了Hippo信号通路的活性。
该研究的相关成果以研究论文“HnRNPR-mediated UPF3B mRNA splicing drives hepatocellular carcinoma metastasis”为题,发表在国际学术期刊《Journal of Advanced Research》上(中科院1区、JCR 1区,IF 10.7)。
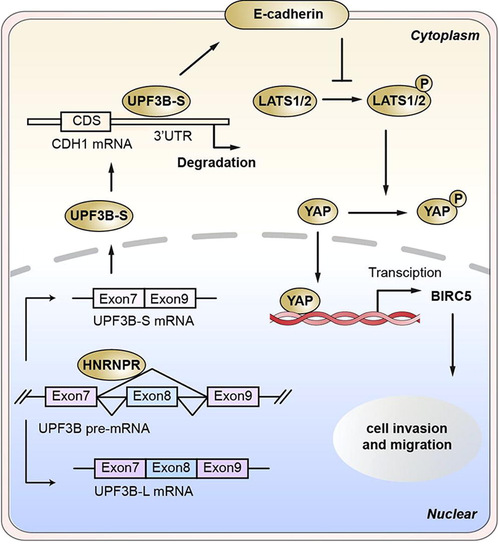
剪接因子HnRNPR介导剪接变体UPF3B-S促进肝癌侵袭转移的分子调控示意图
本研究的发现为肝细胞癌的临床治疗和预后评估带来了新的希望。随着对UPF3B-S功能的深入理解,未来有望开发出针对这一剪接变体的靶向治疗药物,为HCC患者提供更有效的治疗方案。
原文链接:https://www.sciencedirect.com/science/article/pii/S2090123224000729?via%3Dihub

