近日,暨南大学生命科学技术学院何庆瑜教授课题组基于热稳定靶标鉴定技术揭示了小分子莪术醇克服非小细胞肺癌TRAIL耐药的新敏化机制,发现了莪术醇在无明显毒副作用的浓度下,能够显著敏化非小细胞肺癌(NSCLC)细胞,促进TRAIL最大程度杀伤肿瘤细胞,并详细解析了莪术醇通过靶向NQO2敏化TRAIL耐受的肿瘤细胞的分子机制。
TRAIL是肿瘤坏死因子超家族(TNFSF)成员,它与目前临床上使用的敌我不分的化疗药物相比,能够选择性杀伤绝大数肿瘤细胞而对人体正常细胞无明显细胞毒性,是细胞凋亡领域抗肿瘤药物的研究热点。然而许多肿瘤细胞包括NSCLC细胞对TRAIL产生耐受,进而限制其临床应用。有研究表明,肿瘤细胞表面TRAIL受体(如DR5)的丢失,是导致肿瘤对TRAIL钝化的重要原因,因此,重塑肿瘤表面受体是提高TRAIL治疗效果的关键。寻找无毒副作用的辅助药物来提高肿瘤细胞对TRAIL的敏感性,是当前解决TRAIL耐受问题的关键挑战。在对天然产物化合物库的筛选及体内体外实验中,莪术醇不仅毒副作用小,而且能够显著协同TRAIL杀伤NSCLC细胞(图1),引起了科研人员的极大关注。
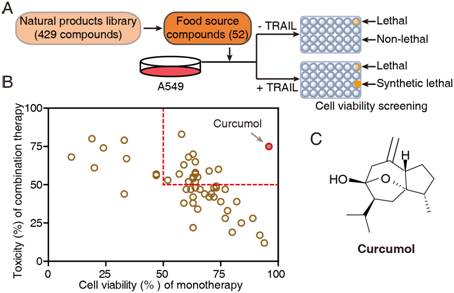
图1.TRAIL敏化剂的筛选流程图。
寻找小分子药物的作用靶点,一直是药物研究领域的难点。在本课题中,研究人员首次将蛋白质热稳定技术与稳定同位素标记质谱技术(SILAC)联合应用,对莪术醇的靶标蛋白进行深度挖掘,发现NQO2蛋白为莪术醇的候选靶标蛋白(图2)。随后,经过一系列分子动力学、分子生物学、分子模拟等实验,发现莪术醇通过靶向NQO2蛋白,激发肿瘤细胞内部的内质网应激,激活CHOP-DR5通路,进而大幅度提高肿瘤细胞表面TRAIL受体DR5的表达,从而提高肿瘤对TRAIL的敏感性(图3)。
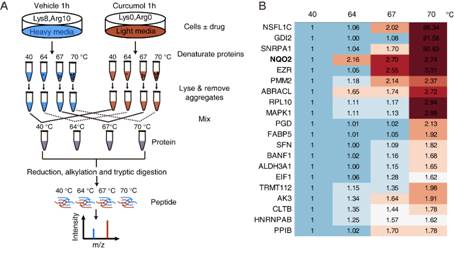
图2. 热稳定定量质谱技术鉴定NQO2为莪术醇的潜在靶标蛋白。
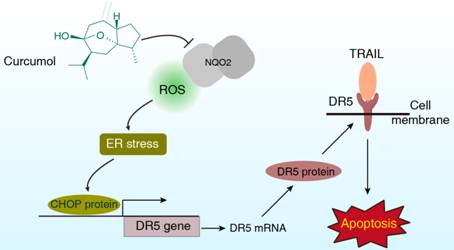
图3. 机制图:莪术醇能够通过抑制NQO2敏化耐受TRAIL的肿瘤细胞,进而促进TRAIL诱导的肿瘤细胞凋亡。
本研究延续肿瘤细胞“受体重建”策略,利用蛋白热稳定靶标鉴定质谱技术发现了TRAIL受体DR5“重建”的关键分子NQO2,阐明了该蛋白在TRAIL耐受中的作用,其在临床肿瘤中的表达量将为莪术醇与TRAIL联用的临床获益及有效性提供重要参考。
本研究所提出的莪术醇与TRAIL在制备抗肿瘤联合用药中的应用,已经获批专利(专利号:201810802651.0)。
本文的第一作者为博士后张静,何庆瑜团队的汪洋副研究员为本文的共同通讯作者。本工作受到国家重点研发计划项目(2017YFA0505100)、国家自然科学基金(31770888)、广东省自然科学基金(2019A1515010196,2019A1515110597)、中国博士后科学基金(2018M643372)、暨南大学科研培育与创新基金(31770888)等基金的支持。
原文链接:https://pubmed.ncbi.nlm.nih.gov/33240775/

